为解决急性髓系白血病(AML)复发难题,中山大学研究团队在Biomaterials发表题为“Bone marrow microenvironment-responsive polymeric-drug/siRNA regulate leukemia stem cells assisting for prevention of AML relapse”的研究论文,本研究设计了一种靶向骨髓微环境的缺氧响应型聚合物-药物/siRNA共递送系统PPLFazo/siFis1@C,该系统通过阻断CXCR4/CXCL12轴促使白血病干细胞(LSCs)迁出骨髓庇护所,同时沉默线粒体分裂蛋白Fis1基因削弱LSCs干性,显著增强化疗敏感性,该研究为AML复发防治提供了新思路。
PPLFazo/siFis1@C系统作用机制:
该系统将阳离子聚合物Plerixafor与偶氮苯接头(PPLFazo)和Fis1 siRNA(siFis1)特异性地共同递送到骨髓,以靶向具有骨髓微环境响应肽涂层(C)的白血病干细胞(LSC)
(1)Plerixafor:通过阻断CXCR4和CXCL12之间的相互作用来促进LSC从骨髓生态位中释放,迫使LSCs 离开 “安全区”,暴露在化疗药物的攻击范围内。
(2)Fis1 siRNA:沉默Fis1后,LSCs 的线粒体自噬功能受损,自我更新能力骤降,最终失去 “永生” 特性,变得对化疗敏感。
(3)肽涂层(C):通过骨髓中高浓度的Ca2+结合,实现靶向富集;而在缺氧环境中,偶氮苯连接子会被特异性切断,精准释放药物和siRNA,避免对正常组织的误伤。
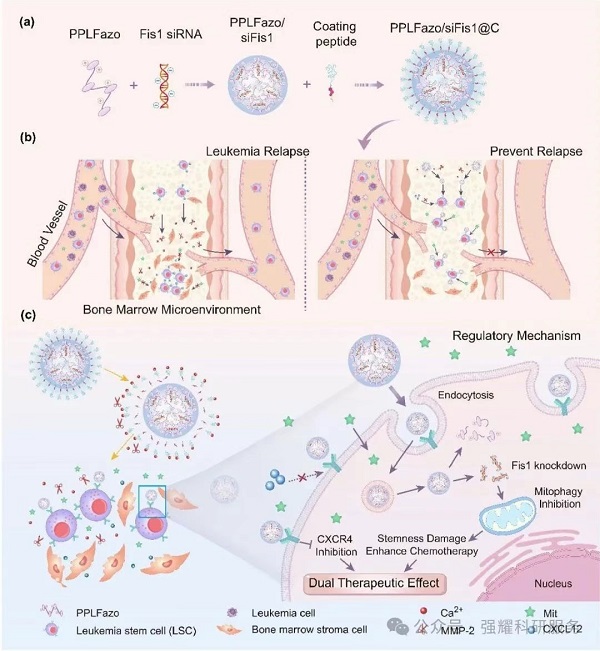
Fig. 1.PPLFazo/siFis1@C在骨髓微环境中调节LSCs
一、研究背景与目的
1. 急性髓系白血病(AML)的现状与挑战
AML是一种恶性血液肿瘤,尽管强化诱导化疗和异基因造血干细胞移植取得了进展,但复发和难治性AML的五年生存率仅约10%。
化疗后耐药白血病干细胞(LSCs)的持续存在是AML复发的主要原因。LSCs具有无限自我更新能力,能迁移到骨髓低氧微环境中逃避化疗药物。
2. 现有治疗策略的局限性
传统化疗难以有效靶向LSCs,免疫疗法如CAR-T因缺乏理想靶点和免疫抑制微环境面临挑战。
破坏LSCs与骨髓微环境的相互作用及抑制其内在干性是关键,但现有研究多聚焦于直接清除AML细胞,对LSC耐药机制探索不足。
3. 研究目的
传统疗法对此束手无策,亟需能同时破坏LSCs"避难所"和消除其"再生能力"的创新策略。开发一种响应骨髓微环境的聚合物-药物/siRNA递送系统,精准共递送CXCR4拮抗剂普乐沙福(plerixafor)和靶向线粒体分裂蛋白 1(Fis1)的siRNA,以抑制LSCs迁移和干性,辅助预防AML复发。
二、技术与方法
研究采用了几项关键技术:
(1)通过迈克尔加成反应合成缺氧响应型偶联剂并构建聚合物PPLFazo。
(2)利用静电作用负载siRNA形成纳米复合物;设计MMP-2/Ca2+ 。
(3)双响应肽涂层实现骨髓靶向;建立AML小鼠模型验证体内疗效。

三、关键结果
1. 纳米系统表征
(1)PPLFazo/siFis1@C在血清中48 h稳定,与缺少偶氮苯连接体的PP/siFis 1相比,PPLFazo/siFis 1在低氧环境下4 h显著释放siRNA,且均未表现出显著的细胞毒性。
(2)与低CXCR 4表达的C1498细胞相比,正常细胞和表现出高CXCR 4水平的细胞均表现出PPLFazo/siFis 1摄取的逐渐增加。表明细胞摄取依赖CXCR4,且CXCR4高表达细胞摄取量是低表达细胞的2~3倍。
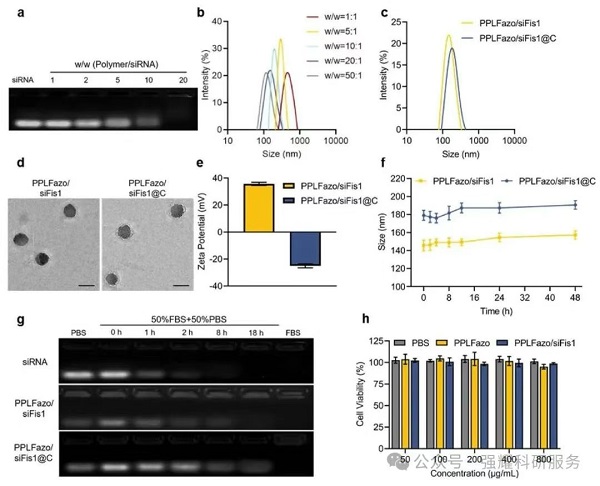
Fig 2. PPLFazo/siFis1@C复合物的理化表征
2. 体外功能验证
体外实验显示,PPLFazo/siFis1@C在模拟骨髓微环境下能快速释放有效成分。
(1)在缺氧条件下,PPLFazo/siFis 1显著减弱了Fis 1 mRNA的表达,表明PLFazo/siFis1@C纳米颗粒在缺氧细胞微环境中能有效地递送siRNA并沉默基因。
(2)用PPLFazo/siFis 1处理的C1498细胞中的线粒体膜电位降低,导致线粒体功能紊乱和干性标志物(如CD34+、CD38-)表达减少;线粒体自噬标志物LC3-II/I 比率下降,Western进一步证实Fis 1沉默导致线粒体自噬的下调。
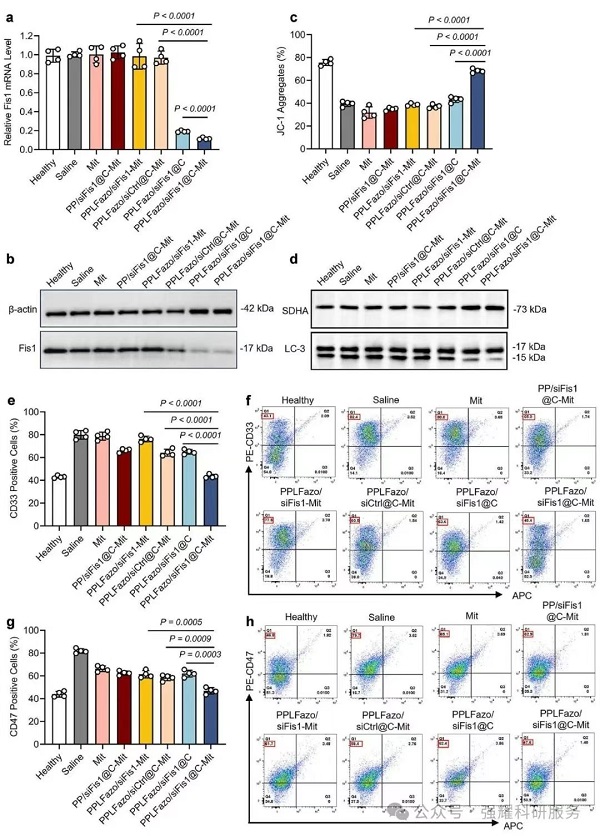
Fig 3. PPLFazo/siFis1@C对Fis1敲除能力的评价和线粒体自噬抑制作用
3. 体内治疗效果
基于体外细胞摄取结果,为了进一步证实PPLFazo/siFis1@C在白血病小鼠体内的骨髓靶向性,将C1498细胞以一定剂量静脉注射到C57/BL 6小鼠体内,建立白血病小鼠模型。
(1)纳米颗粒注射1 h后在骨髓富集,荧光强度是对照组4倍。
(2)联合3 mg/kg米托蒽醌治疗,AML小鼠生存期延长至42天,脾脏重量减少约 50%,WBC计数降至正常水平。
(3)米托蒽醌剂量优化至4 mg/kg时,50天生存率近70%,CD33+和CD47+细胞清除率超50%。
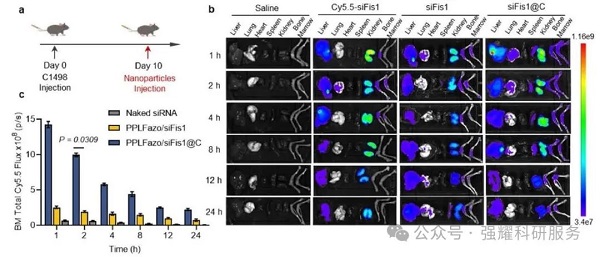
Fig 4. PPLFazo/siFis1@C在AML小鼠体内的生物分布及骨髓靶向作用
4. 安全性评估
动物实验中,经该纳米系统联合阿糖胞苷治疗的AML小鼠,骨髓中LSCs比例较对照组下降90%,中位生存期延长2.3倍。组织分布实验证实纳米颗粒在骨髓中的蓄积量是普通制剂的5.8倍,得益于肽涂层与骨髓钙离子的特异性结合。
(1)主要器官(心、肝、脾、肺、肾)H&E染色无明显损伤,血液学指标正常。
(2)不影响人CD34+ 造血干细胞活力和集落形成能力。
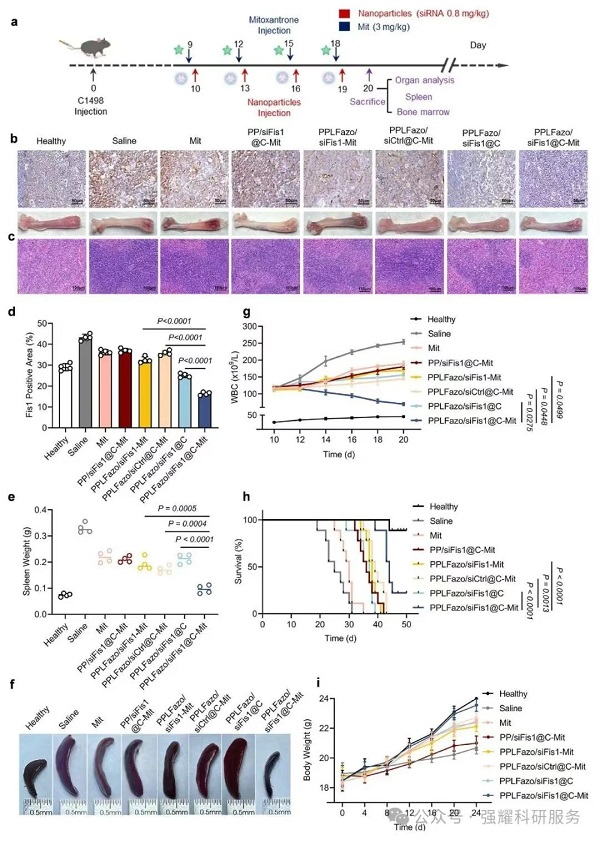
Fig 5. PPLFazo/siFis1@C在AML小鼠模型中的初始治疗效果
四、结论与展望
该研究创新性地将微环境响应型材料设计与LSCs清除策略相结合,突破了传统疗法的两大局限:一是物理屏障导致的药物递送效率低,二是单一靶向策略易产生耐药性。通过同时干预CXCR4/CXCL12趋化轴和Fis1介导的线粒体自噬通路,实现了对LSCs"栖息地"和"生存技能"的同步破坏。这种双管齐下的策略为AML复发防治提供了新思路,其模块化设计也可拓展至其他肿瘤干细胞的靶向治疗。
值得注意的是,该系统的肽涂层技术巧妙地利用了骨髓特有的高钙和MMP-2微环境,既避免了血液中的非特异性清除,又实现了病灶部位的特异性蓄积。而缺氧响应型释放机制则确保药物在靶细胞内精准释放,这种时空双重调控策略为肿瘤靶向递送系统设计提供了重要参考。研究团队Yiqiu Zhang、Shihong Cheng等通过跨学科合作,将药物化学、纳米技术和分子生物学手段有机结合,展现了转化医学研究的巨大潜力。
本研究中肽涂层(C)由强耀生物合成;强耀生物提供多肽合成,蛋白和抗体制备等优秀服务助力科研


 联系我们
联系我们
 返回
返回