M9 胶原酶由于其高活性和对胶原蛋白的特异性而具有各种生物技术和医学应用。尽管已经研究了 M9 胶原酶的胶原分解机制,但其切割位点特异性的分子基础仍然未知。山东大学研究团队在 J.Agric.FoodChem 发表了题为“Mechanistic Insight into the Cleavage Site Specificity of Vibrio Collagenase VhaC to the Y−G Bonds in Collagen”的研究论文,本文以 M9 家族胶原酶 VhaC 为模型,阐明了 M9 胶原酶对胶原蛋白 Y-G 键切割特异性的分子机制,推进了 M9 胶原酶在疾病治疗和胶原寡肽生产中的应用。
一、研究背景
胶原蛋白是动物体内最丰富的结构蛋白,以 G-X-Y 重复序列形成三螺旋结构,对多数蛋白酶具有抗性。仅少数酶可水解天然三螺旋胶原蛋白,包括哺乳动物基质金属蛋白酶和细菌胶原酶,其中细菌胶原酶主要属于 MEROPS M9 家族,分为M9A亚家族(颤音胶原酶)和M9B(梭状芽胞杆菌胶原酶)。
M9 胶原酶因高胶原水解效率和特异性,在生物技术及胶原寡肽生产中应用广泛。研究表明,M9胶原酶的特点是对胶原多肽链中P1 '位置的甘氨酸肽键(Y - G键)具有很高的裂解位点特异性,但该特异性的分子机制尚未完全阐明。
二、研究方法
三、研究结果
1.VhaC对Y-G键的切割特异性验证
为了研究VhaC对胶原Y−G键的特异性,通过 LC-MS 鉴定重组 VhaC(仅含胶原酶模块 CM)对 9 条牛 I 型胶原来源合成肽的切割产物,明确切割位点。
结果显示,VhaC 可切割所有测试肽段,且所有切割键的 P1' 位均为甘氨酸(G),直接证实 VhaC 对胶原蛋白 Y-G 键(P1' 为 G)的高度切割特异性,与前期 “VhaC 偏好水解 I 型胶原纤维 Y-G 键” 的结论一致。

图1. 胶原肽上VHAC的裂解位点的示意图
2.VhaC 中识别 P1' 甘氨酸的关键残基筛选
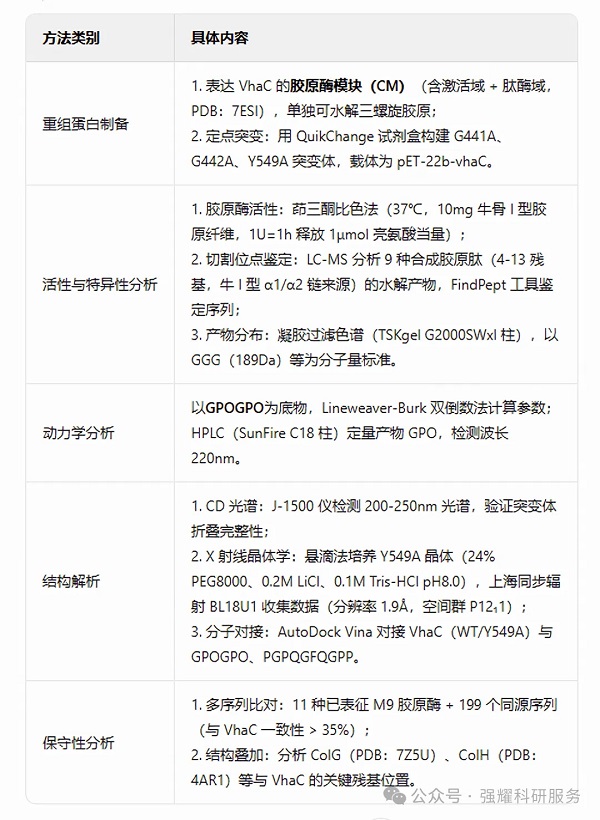
(1)结构模拟(图 2A-B)
VhaC 与胶原肽 GPOGPO 的对接模型显示,P1' 甘氨酸的羰基氧 / 氨基氮分别与 G441 的氨基氮 / G442 的羰基氧形成主链相互作用,Y549 的羟苯基与双 G 基序相对,共同构成 S1' 底物口袋。
(2)突变体活性(图 2C)
G441A/G442A 突变后,胶原酶活性保留 23.7%-25.8%(WT 为 100%);Y549A 突变后,活性仅残留 1.4%,提示 Y549 对催化至关重要。
(3)结构完整性验证(图 2D)
所有突变体的圆二色谱(CD)与 WT 一致,证明活性下降源于残基功能改变,而非蛋白整体折叠异常。
(4)底物口袋差异(图 2E-G)
VhaC 的底物识别位点无 M9B 家族胶原酶 ColG 的 “壁状环(Q⁵¹¹-QSI-F⁵¹⁵)”,其对应环(A⁴⁶⁶-NPD-H⁴⁷⁰)远离 S1'-S3' 位点,使底物结合沟更宽敞。
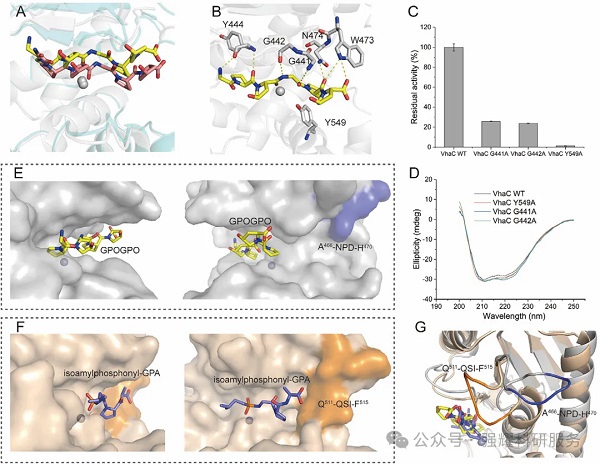
图2. 对VHAC中P1'甘氨酸识别的关键残基的分析
3.双 G 基序与 Y549 对 VhaC 切割特异性的影响
(1)胶原水解产物分析(图 3A-B)
WT、G441A、G442A 的水解产物均含 3 个峰(对应九肽、六肽、三肽,峰 III 为 G-X-Y 三肽),G441A/G442A 的峰 III 面积仅轻微下降(WT 约 60.45%,突变体约 49.76%-57.42%),说明双 G 基序主要影响催化效率,不改变切割特异性;Y549A 的峰 III 面积大幅降至 38.15%,提示三肽产物减少,切割特异性被破坏。
(2)合成肽切割位点(图 3C)
G441A/G442A 仍主要切割 Y-G 键(仅部分肽段切割位点减少);Y549A 不仅丢失多数 Y-G 键切割能力,还出现非 Y-G 键切割(如 G-I、G-F 键),直接证明 Y549 是维持 Y-G 键切割特异性的核心。
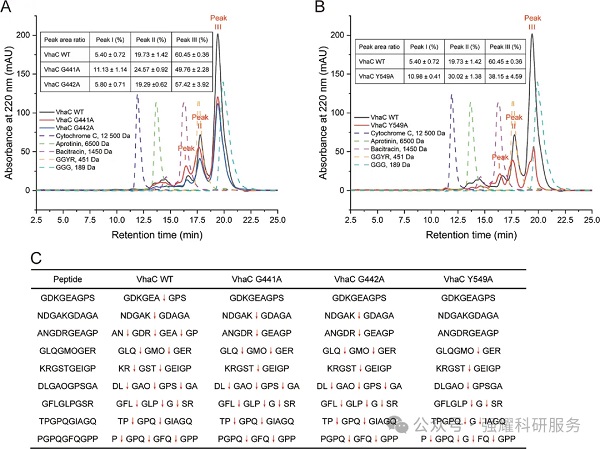
图3. 双G基序和Y549突变对VHAC对胶原蛋白Y-G键的裂解位点特异性的影响
4.Y549 调控切割特异性的结构基础
(1)整体结构(图 4A-B)
Y549A 仍呈WT 的 “鞍形结构”,结合的肽 1(22LSEPSQQVTEIYQHHAHQNGN-42)完全占据底物结合沟,排除结构折叠异常的干扰。
(2)S1' 口袋差异(图 4C-D)
WT 中 Y549 的大侧链形成 “突起”,与双 G 基序共同构成狭窄的 S1' 口袋,仅能容纳无侧链的甘氨酸;Y549A 中 alanine(A)的小侧链消除 “突起”,使 S1' 口袋显著扩大,可容纳带侧链的氨基酸(如苯丙氨酸 F)。
(3)分子对接验证(图 4E-F)
WT 与肽 PGPQGFQGPP 对接时,切割 Y-G 键(P1' 为 G);Y549A 对接时,S1' 口袋容纳 P1' 位的 F,切割位点变为 G-F 键,与图 3C 中 Y549A 切割该肽的实验结果一致。
图4. 突变体VHAC Y549A在VHAC对P1'甘氨酸的特定识别中的作用
5.M9 家族胶原酶的关键残基保守性
(1)序列保守性(图 5A-B)
11 个已鉴定的功能性 M9 胶原酶(如 ColG、ColH、Ghcol、VP397)中,与 VhaC G441/G442 同源的双 G 基序、与 Y549 同源的 S1' 酪氨酸严格保守;199 个 M9 胶原酶序列(与 VhaC 同源性 > 35%)的保守图谱进一步确认该保守模式。
(2)结构保守性(图 5C)
VhaC、Ghcol、ColG、ColH、ColT 的结构叠加显示,双 G 基序与 S1' 酪氨酸的空间位置和取向完全一致,提示该机制在 M9 家族中普遍适用,是其特异性切割 Y-G 键的共同分子基础。
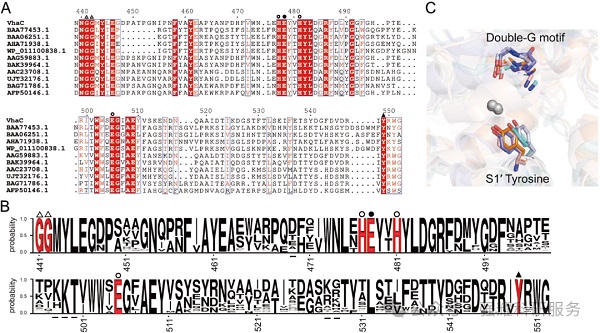
图5. 对M9家族胶原酶的保守分析
四、研究总结
本研究以VhaC为模型,探究 M9 胶原酶 VhaC 的 Y-G 键切割机制,发现 VhaC 的双 G 基序(G441、G442)与Y549构成狭窄的S1'底物结合袋以结合 P1' 底物,其中 Y549 是 P1' 甘氨酸特异性识别的关键——其庞大侧链限制了带侧链残基的容纳。且VhaC Y549 对应的 S1' 酪氨酸在 M9 胶原酶中严格保守,提示其对切割特异性的重要性,为胶原酶的定向改造(如优化胶原寡肽生产)和致病菌抑制剂开发提供了分子依据。
本研究中源自牛 I 型胶原蛋白 α₁链和 α₂链的合成胶原蛋白肽由强耀生物提供;强耀生物提供多肽合成,蛋白和抗体制备等优秀服务助力科研。


 联系我们
联系我们
 返回
返回